- 基于患者卵巢癌细胞而制作的活性 “类器官(organoids)” 测试证实其在预测肿瘤对化疗药物的敏感度或抵抗性方面要比DNA排序(DNA sequencing)更精准
- 基于患者肿瘤样本而来的卵巢癌类器官的制作过程仅需7-10天,其它类器官则需要数周甚至数月,从而前者为开发快速、直接的药物及药物组合测试提供契机
- 本研究制作的类器官包含免疫细胞(immune cells),科学家表示这有望开展针对卵巢癌免疫疗法药物的测试
丹娜—法伯癌症研究所的科学家们表示,基于患者卵巢癌细胞而制作的活性 “类器官(organoids)” 测试证实其在预测肿瘤对化疗药物的敏感度或抵抗性方面要比DNA排序更精准,且将类器官与DNA排序(DNA sequencing)两者结合的疗效更佳。
本研究被发表在《癌症∙探索》期刊(Cancer Discovery)上,研究人员报告称:基于卵巢癌(ovarian cancer)肿瘤患者样本的类器官制作过程仅需7-10天,它是一种模仿肿瘤形态的微小三维体细胞。相反地,其它实体肿瘤(solid tumors)——如:胰腺癌(pancreatic cancer)、结肠癌(colon cancer)以及前列腺癌(prostate cancer)——的类器官的制作过程可长达数周至数月,届时,癌细胞或许已出现基因变化,这就让科研人员在仿制患者癌症方面少了很多相似的依据。
“正因为这些卵巢肿瘤类器官的制作过程很快,所以我们能够开展快速、直接的药物测试及药物组合,以预测患者的反应” ,本研究的资深作者Alan D’Andrea博士(Alan D’Andrea, MD)说道。D’Andrea博士是丹娜—法伯癌症研究所苏珊·F·史密斯女性癌症中心(Susan F. Smith Center for Women’s Cancers)的主任,亦负责指导研究所DNA损害和修复中心(Center for DNA Damage and Repair)的工作。
D’Andrea博士还特别指出,医界还需要进行更大规模的研究,以验证乳腺癌类器官的可靠性,并使其达到监管标准。
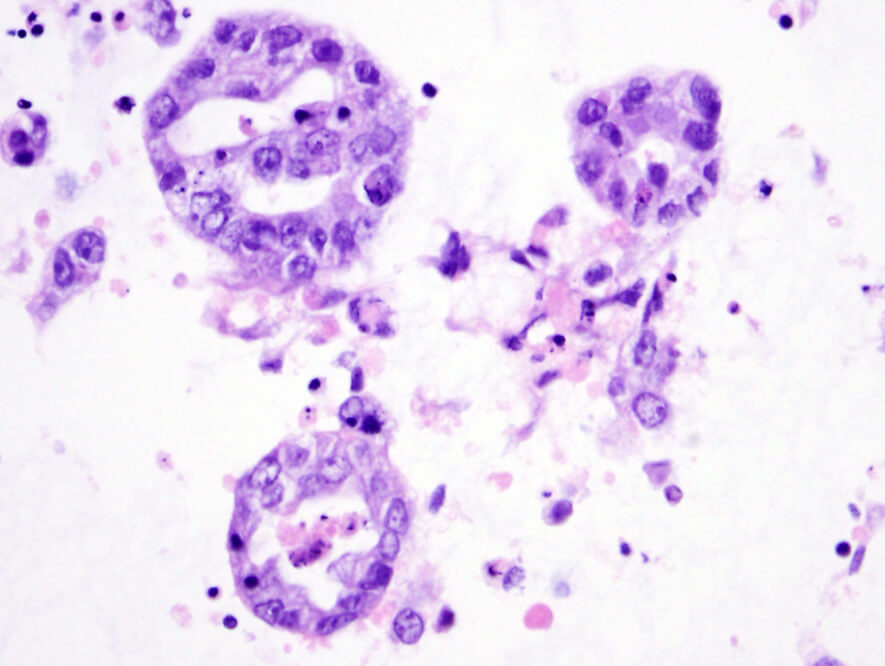
我们可从显微镜下观察到,卵巢癌类器官呈空心球体状,其细胞壁由癌细胞构成
从手术室到实验室
本研究的第一作者是丹娜—法伯癌症研究所与布莱根和妇女医院(Brigham and Women’s Hospital)的一位病理学家——Sarah J. Hill博士(Sarah J. Hill, MD, PhD)。Hill博士对33个类器官进行了详细描述,这些类器官是从22位高分化卵巢癌(high grade ovarian cancer)患者处取样制成的。高分化卵巢癌是最致命的一种卵巢癌,Hill博士在丹娜—法伯/哈佛大学癌症中心(Dana-Farber/Harvard Cancer Center)及布莱根与妇女医院的妇科肿瘤外科医生的帮助下,从手术室中获得卵巢肿瘤组织样本,随后在实验室内用这些细胞来制作类器官。每一个类器官都含有100-200个癌细胞,大小约为打印文档一行句子。引人注目的是,90%的患者样本都被制成了可用的类器官,该比例比其它类型的实体肿瘤类器官的可用比例都高很多。此外,研究人员还发现这些类器官含有免疫细胞,这对今后测试用免疫疗法药物治疗卵巢癌起奠定作用。
许多高分化卵巢癌都因DNA的变化而弱化,这些DNA变化会损害肿瘤细胞修复基因损害的能力,而以这种弱势之处为靶点正是化疗的基础。在手术之外,初始疗法还有铂类药物(platinum-based drug)和紫杉醇(paclitaxel)药物的组合疗法;铂类药物能够损害肿瘤DNA。目前还没有能够预测哪些患者对铂类药物呈敏感性的好方法,且很多患者最后都对铂类药物呈现了抵抗性。
PARP(全称为聚腺苷二磷酸核糖聚合酶)抑制剂是另外一类杀死携带残缺DNA损害修复机制的肿瘤细胞的药物。携带BRCA1和BRCA2突变的高分化卵巢癌往往对PARP抑制剂起反应,但是目前尚未有能够预测哪些患者会对PARP药物起反应的测试。以ATR和CHK1抑制剂为代表的新药物或许能够在PARP抑制剂无效时起作用。
类器官对DNA修复状态的预测
目前,医界还用基因组测试(genomic testing)来预测患者对DNA损害修复药物的敏感度。然而,Hill博士指出: “我们认为,仅凭基因组数据一项并不能准确地预测出高分化卵巢癌真正的DNA修复能力,而对选择靶向药物而言,我们还要一个能马上投入使用的方法” 。
当研究人员对完成制作的类器官进行分析时,他们发现这些类器官与患者肿瘤的基因组成部分高度匹配,且没有出现新的突变。其中一个重要的发现是:大部分类器官对PARP抑制剂——奥拉帕尼(olaparib)并不敏感,预示了肿瘤在同源重组(homologous recombination)方面没有缺陷,尽管基因组测试曾显示出很多肿瘤会有同源重组缺陷;同源重组是DNA损害修复的类型之一。Hill博士说道: “尽管PARP抑制剂敏感性很低这一点让我们很震惊,但是我们的实验还是显示出它比单独用基因预测更为准确的结果” 。这些类器官还对研究其它有关敏感度的机制或对损害肿瘤DNA药物的耐药性机制有重要意义。
研究人员还说道: “在很多案例中,类器官培养的药物反应与相应患者的临床反应呈现出良好的相关性” ,这就彰显了类器官方法的潜在价值。D’Andrea博士说道: “在一些案例中,我们能对患者的管理进行改变,并给他们开具一种不同的药物” 。
他强调,早期检测方法的缺失仍是防止卵巢癌致死的最大桎梏,他说道: “目前医界还没有相关的办法” 。但与此同时,对于患有卵巢癌并用现代技术治疗的女性而言,类器官疗法呈现出价值。
“正因为这些卵巢肿瘤类器官的制作过程很快,所以我们能够开展快速、直接的药物测试及药物组合,以预测患者的反应” ,本研究的资深作者Alan D’Andrea博士(Alan D’Andrea, MD)说道。D’Andrea博士是丹娜—法伯癌症研究所苏珊·F·史密斯女性癌症中心(Susan
F. Smith Center for Women’s Cancers)的主任,亦负责指导研究所DNA损害和修复中心(Center for DNA Damage and Repair)的工作。
D’Andrea博士还特别指出,医界还需要进行更大规模的研究,以验证乳腺癌类器官的可靠性,并使其达到监管标准。
转载须知
阁下若有媒体联络需求,敬请致电617-632-4090,请阁下指明与媒体团队洽谈;或请发邮件至media@dfci.harvard.edu。阁下如欲转载本文,请发邮件至kun_ma@dfci.harvard.edu,未经授权禁止转载,感谢合作。

