逆向开发案例:丹娜—法伯科学家们破解肠自愈机制的长期争论
逆向开发案例:丹娜—法伯科学家们破解肠自愈机制的长期争论

右为Ramesh Shivdasani博士(Ramesh Shivdasani, MD, PhD)
2020年2月20日——美国马萨诸塞州波士顿讯
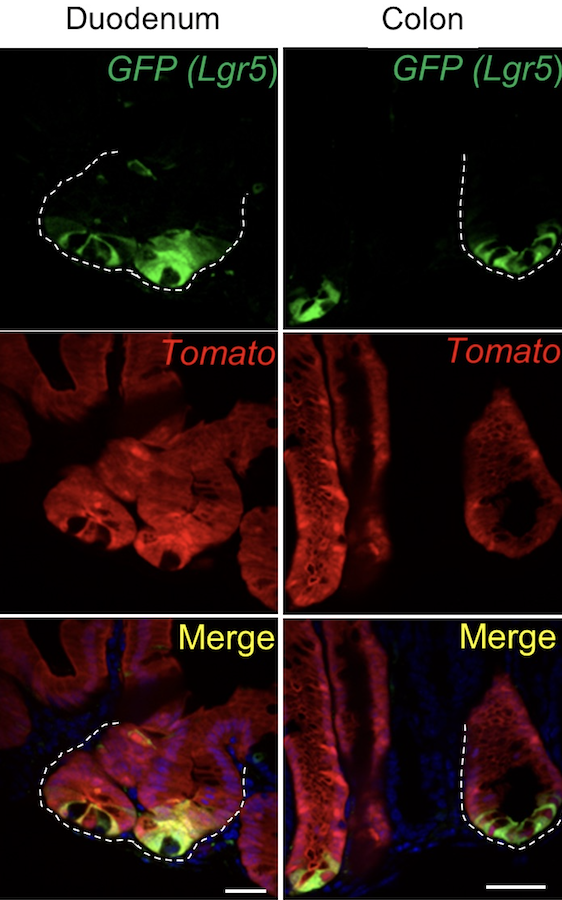
人体肠黏膜深处存有该器官自我更新和修复损伤的动力:肠干细胞(intestinal stem cells,简称ISCs),位于名为隐窝(crypts)的组织囊里。肠干细胞生成使肠粘膜不断繁殖的细胞。甚至这些干细胞自身也具有一个安全的网络:当干细胞损坏时,健康的新干细胞在不到一周的时间里就可生成。
数年来,科学家们一直就肠干细胞如何重建的议题争论不休。有些人认为,肠道存储了大量的肠干细胞——正如一种备用的供应——以补充丢失的一线肠干细胞留下的空缺。另一派学者则认为,这其中还需要更为复杂的工作:肠干细胞正如蜂后一般,生产更为特化或“分化”的后代——在人体肠道的案例中,肠干细胞的子细胞构成了肠内壁;当肠干细胞遭到破坏时,其子细胞逆转并“去分化(de-differentiate)”——转化成原先生成自身的肠干细胞。
一项由丹娜—法伯癌症研究所科学家们带领的新研究有力地证实了上述第二种学说。今日,《细胞∙干细胞》期刊(Cell Stem Cell)的线上版发表了该研究的相关成果。研究人员发现肠干细胞及其子细胞有着惊人的互反关系:在正常条件下,肠干细胞分化成子细胞,且若肠干细胞损失,其子细胞就会逆转,成为肠干细胞。
“我们的研究表明,肠干细胞的重建完全是在去分化过程中产生的。”该研究的资深作者Ramesh Shivdasani博士(Ramesh Shivdasani, MD, PhD)说道。Shivdasani博士在丹娜—法伯、布莱根和妇女医院(BWH)以及哈佛干细胞研究所(Harvard Stem Cell Institute)供职。“我们证实了肠道内无需存储肠干细胞。”
在其研究基础上,研究人员还能够实时捕获去分化的过程。Shivdasani博士解释道,当细胞开始去分化时,它们开启了一种可以通过实验室技术将其分离并采集的基因。在此过程中,研究人员能够从连续的去分化中捕获肠干细胞。Shivdasani博士将这一过程比拟为棒球比赛,其中,跑垒员在一垒和二类之间被标记出来。
大量周转(Heavy turnover)
肠是人体内仅有的三个器官之一,其余两者为皮肤和血液,其中细胞不断周转——死亡以及被新鲜的细胞所取代。它们拥有这种品质是因为它们是与外界物质接触最为紧密的组织,与潜在的有害物质接触同理。据悉,不断周转是防止毒害物质在细胞及其子代上产生持久影响的一种方式。
从某种意义而言,保存肠干细胞的隐窝命名有误。隐窝绝不是埋葬死细胞的围栏,而是干细胞每天分化十亿子细胞的场所,这些子细胞取代了死亡肠细胞。
肠干细胞的主要特征之一是它们极为放射敏感,或对辐射敏感。例如,被暴露在高水平放射性环境(放射性沉降物形式)的人群能遭受严重的肠损伤,这是因为肠干细胞的缺失阻碍了细胞生成,从而无法修复受损组织。但若肠干细胞轻易屈从于辐射,那么它们也会迅速地返回。因放射引起的肠损伤患者能存活一周,随着其体内肠干细胞水平反跳,这类患者往往能康复。
为判定上述反跳(rebound)是否因大量存储的肠干细胞引起,还是因子细胞去分化引起,Shivdasani博士和合作伙伴们进行了一种延时试验(time-lapse experiment)。他们用他莫昔芬药物(tamoxifen)处理了一组肠干细胞,该药物引发细胞及其子代呈荧光色。他们等待了48小时,荧光标记被固定住,随后杀死了肠干细胞。若子细胞确实在去分化,那么在48小时节点后生成的任何肠干细胞都将呈荧光色。而这正是研究人员发现的现象。
尽管科学家们能够利用实验室技术将多种分化的细胞转化为干细胞,但Shivdasani博士和同仁们的发现却证实了去分化远不止是自然界的一个奇异之举;它是肠道内修复受损干细胞的主要方式。目前,学者们尚未明确其它器官和组织中的细胞亦具有这种能力,但该议题仍是一个值得深入研究的领域。
“此外,隐窝如何知晓干细胞已经死亡并需要替换的机制也尚未可知。” Shivdasani博士强调,“子细胞如何接收到去分化的信号也不明确。这是我们目前正在探索的一个议题。”
该研究的主要作者为丹娜—法伯及布莱根和妇女医院的Kazutaka Murata博士(Kazutaka Murata, PhD of Dana-Farber and BWH)。联合作者包括:丹娜—法伯及布莱根和妇女医院的Unmesh Jadhav博士(Unmesh Jadhav, PhD)和Alessia Cavazza博士(Alessia Cavazza, PhD);丹娜—法伯的Shariq Madha, Justin Dean, Kai Wucherpfennig, MD, PhD和Franziska Michor, PhD;以及来自胡布勒支研究所(Hubrecht Institute)、荷兰皇家艺术和科学学院(Royal Netherlands Academy of Arts and Sciences)和荷兰乌特勒支大学医学中心(University Medical Centre, Utrecht, the Netherlands)的Johan van Es博士(Johan van Es, PhD)和Hans Clevers博士(Hans Clevers)
该研究由美国国立卫生研究院(NIH grants R01DK081113, U01DK103152, and P50CA127003)和林德家族(the Lind family)赞助支持。
媒体联络
阁下若有媒体联络需求,敬请致电617-632-4090,请阁下指明与媒体团队洽谈;或请发邮件至media@dfci.harvard.edu。阁下如欲转载本文,请发邮件至kun_ma@dfci.harvard.edu。
媒体联络
阁下若有媒体联络需求,敬请致电617-632-4090,请阁下指明与媒体团队洽谈;或请发邮件至media@dfci.harvard.edu。阁下如欲转载本文,请发邮件至kun_ma@dfci.harvard.edu。